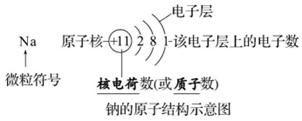
原子结构
目录
1 质子,中子与核外电子

质量数=质子数+中子数
相对原子质量约等于质量数
1.1 举例
重水$\ce{^2H2O}$的相对原子质量$2 \times 2 + 16 = 20$
2 粒子符号周围数学的含义
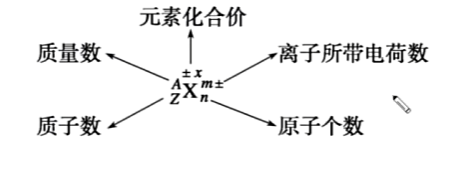
2.1 举例

3 核素与同位素
- 具有相同质子数(核电荷数)的一类原子称为元素。
- 具有一定数自质子和一定数自中子的一种原子称为核素。
- 质子数相同而中子数不同的同一种元素的不同原子互称为同位素。
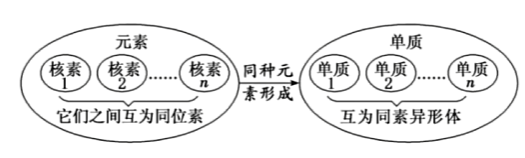
$\ce{^1H}$氕
$\ce{^2H}$氘
$\ce{^3H}$氚
4 电子层
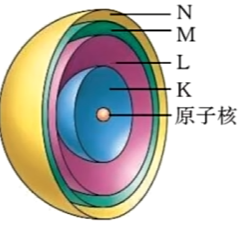
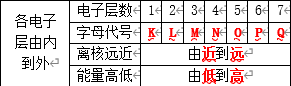
5 核外电子排布规律
5.1 一低
核外电子总是先排布在能量最低的电子层,然后由里向外,依次排布在能量逐步升高的电子层。
5.2 四不超
-
原子核外各电子层最多容纳$2n^2$个电子。
-
原子最外层电子数不能超过$8$个 (K层为最外层时不能超过$2$个)。
-
次外层电子数不超过个$18$个 (当K层或L层为次外层时分别为$2$个和$8$个)。
-
倒数第三层电子最多不超过$32$个。
6 原子(离子)结构示意图