烷烃
1 烃的概念和分类
仅含碳、氢两种元素的有机化合物称为碳氢化合物,也称为烃类。
- 根据碳原子间成键方式的不同分类
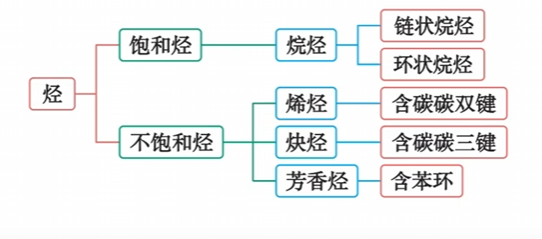
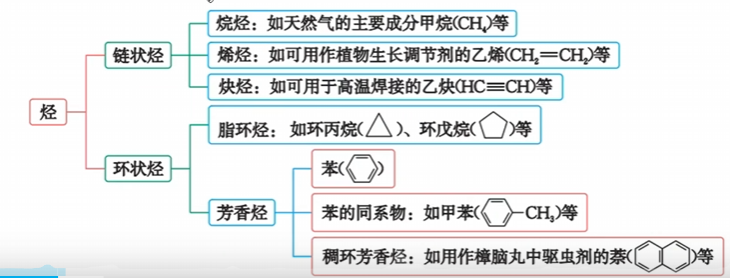
- 根据碳骨架的不同,可以将烃分为链状烃和环状烃
2 甲烷的结构
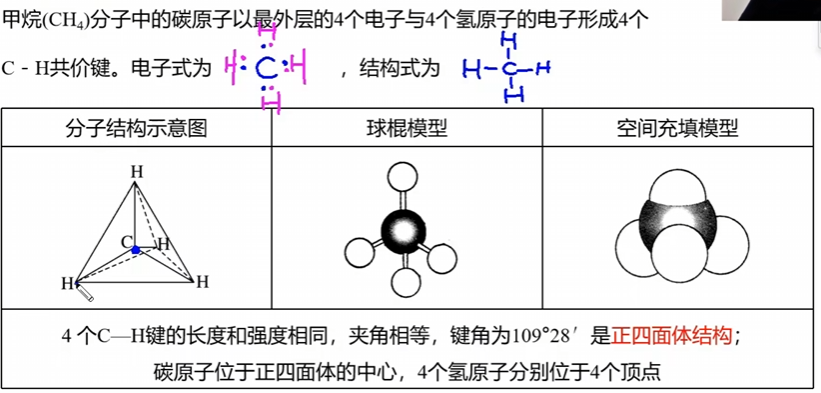
2.1 性质
2.1.1 物理性质
甲烷是一种无色、无味的气体,密度比空气小,极难溶于水。
2.1.2 化学性质
通常状况下,甲烷性质比较稳定,与强酸、强碱、强氧化剂都不反应; 但在特定的条件下,甲烷也能发生某些反应。
- 氧化反应 甲烷在空气中燃烧: $\ce{CH4 + 2O2 ->[点燃] CO2 + 2H2O}$ 现象为安静地燃烧,火焰呈淡蓝色。
2.1.2.1 甲烷与$\ce{Cl2}$的取代反应
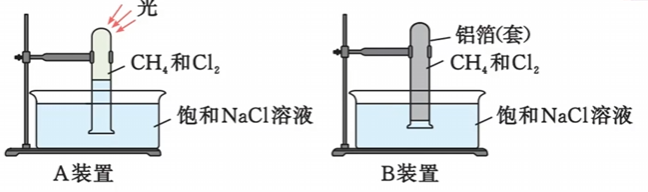
2.1.2.1.1 实验现象
- A装置: 试管内气体颜色遂渐变浅 ($\ce{Cl2}$被反应),试管壁出现油状液滴,试管中有少量白雾,且试管内液面上升,水槽中有固体析出 ($\ce{NaCl}$)。
- B装置: 无明显现象。
2.1.2.1.2 实验结论
$\ce{CH4 + Cl2 ->[光] CH3Cl + HCl}$
$\ce{CH3Cl + Cl2 ->[光] CH2Cl2 + HCl}$
$\ce{CH2Cl2 + Cl2 ->[光] CHCl3 + HCl}$
$\ce{CHCl3 + Cl2 ->[光] CCl4 + HCl}$
取代反应的特点: 有进有出,产物混合。
$\ce{1 mol CH4}$ 至少需要$\ce{4 mol Cl2}$ 才能转化为 $\ce{1 mol CCl4}$。
1.甲烷与氯气反应生成四种有机物$\ce{CHCl3}$、$\ce{CH2Cl2}$、$\ce{CHCl3}$、$\ce{CCl4}$和无机物$\ce{HCl}$,其中$\ce{HCl}$的物质的量最多。
2.连锁反应: 甲烷中的氢原子被氯原子逐步取代,各步反应同时进行,即第一步反应一并始,后续反应立即进行。
3.数量关系: 每取代$\pu{1 mol}$氢原子,消耗$\pu{1 mol \ce{Cl2}}$,生成$\pu{1 mol \ce{HCl}}$。
2.2 烷烃的物理性质
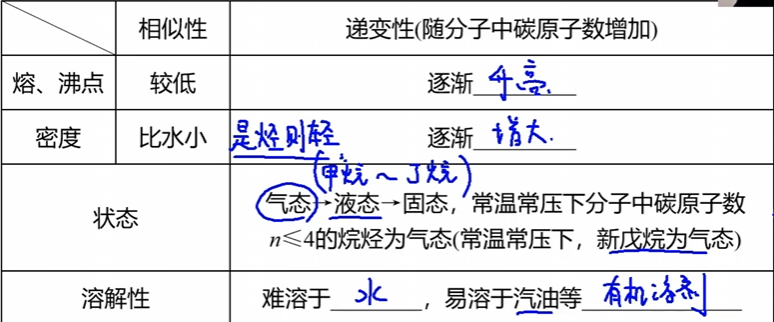
2.3 烷烃的化学性质
-
通常较稳定,不能被酸性高锰酸钾溶液等强氧化剂氧化,也不能与强酸、强碱发生反应。
-
2.烷烃完全燃烧的通式为: $\ce{C_nH_\text{2n+2} + \frac{\text{3n+1}}{2}O2 ->[点燃] nCO2 + \text{(n+1)}H2O}$
-
在光照条件下,烷烃与$\ce{Cl2}$、$\ce{Br2}$,等卤素单质的气体发生取代反应,生成多种卤代产物和相应的卤化氢气体。
烷烃与卤素单质发生一卤代反应的通式为:
$\ce{C_nH_\text{2n+2} + X2 ->[光] C_nH_\text{2n+1}X + HX}$