硫及其化合物
1 硫单质
硫俗称硫磺,黄色晶体,质脆,易研成粉末。 硫难溶于水,微溶于酒精,易溶于二硫化碳。
1.1 化学性质
硫单质既表现氧化性,又表现还原性。
1.1.1 氧化性
硫单质的氧化性较弱,在于变价金属反应时,一般只能生成低价态金属硫化物。
- $\ce{S}$与 $\ce{Na}$、$\ce{Fe}$、$\ce{Cu}$ 等金属反应: $\ce{2Na + S -> Na2S }$ $\ce{Fe + S -> FeS }$ $\ce{2Cu + S -> Cu2S }$ $\ce{Hg + S -> HgS }$ (实验室处理洒落的汞)
- $\ce{S}$ 与 $\ce{H2}$ 反应: $\ce{H2 + S -> H2S }$
1.1.2 还原性
与$\ce{O2}$等活泼非金属单质反应: $\ce{S + O2 -> SO2}$
1.1.3 既体现氧化性又体现还原性
与热的强碱溶液反应: $\ce{3S + 6NaOH ->[\triangle] Na2SO3 + 2Na2S + 3H2O}$
2 $\ce{H2SO4}$
物理性质: 纯硫酸是无色、黏稠的油状液体,沸点高、难挥发。 常用的浓硫酸中$\ce{H2SO4}$的质量分数是$98%$(物质的量浓度为$\pu{1.23 mol* L-1}$),密度为$\pu{1.84g * cm-3}$。 难挥发性: 用于制挥发性酸(如$\ce{HCI}$、$\ce{HNO3}$)。 自然界中的存在形式有硫单质、硫化物和硫酸盐等。
2.1 性质
2.1.1 强酸性
制磷酸: $\ce{Ca3(PO4)2 + 3H2SO4(浓) -> 3CaSO4 + 2H3PO4}$
2.1.2 吸水性
浓硫酸具有强烈的吸水能力,能吸收空气中的水分,甚至能吸收结晶水合物的水,故浓硫酸常用作干燥剂,干燥一些不与浓硫酸反应的气体。
如浓硫酸可干燥$\ce{O2、H2、N2、CO2、Cl2、HCl、CO2、CO、CH4}$等气体,但不能干燥$\ce{NH3、H2S、 HI、HBr}$等气体。
2.1.3 脱水性
浓硫酸具有很强的腐蚀性,能按氢、氧原子$2:1$的比例脱去纸、棉布、木条等有机物中的氢、氧元素。
蔗糖的脱水实验
$$ \begin{aligned} & \ce{C12H22O11 ->[浓H2S04] 12C + 11H2O} \\ & \ce{C + 2H2SO4(浓) ->[\triangle] CO2 ^ + 2SO2 ^ + 2H2O} \end{aligned} $$浓硫酸既体现脱水性又体现强氧化性。浓硫酸具有强腐蚀性与脱水性有很大关系,如浓硫酸会使蓝色石蕊试纸先变红,后变黑。
2.1.4 强氧化性
浓硫酸中的硫元素处于最高价态。 浓硫酸能与许多物质发生氧化还原反应,是常见的氧化剂。金属单质或低价金属的盐与浓硫酸反应时,既显氧化性又显酸性。
- 浓硫酸与木炭反应: $\ce{C + 2H2SO4(浓) ->[\triangle] CO2 ^ + 2SO2 ^ + 2H2O}$
- 与$\ce{Cu}$反应: $\ce{C + H2SO4 ->[\triangle] CuSO4 ^ + SO2 ^ + 2H2O}$
2.1.4.1 钝化
在常温下,浓硫酸与$\ce{Fe,Al}$反应,生成了致密、坚固的氧化膜阻止金属与浓硫酸接触,从而保护了金属。因此常温下可用$\ce{Fe,Al}$制容器盛放浓硫酸。
2.2 硫酸的工业制法
工业上一般用硫磺或其它含硫矿物 (如黄铁矿) 为原料制备硫酸,金属冶炼时产生的含二氧化硫废气经回收后也可用于制备硫酸。
主要方程式:
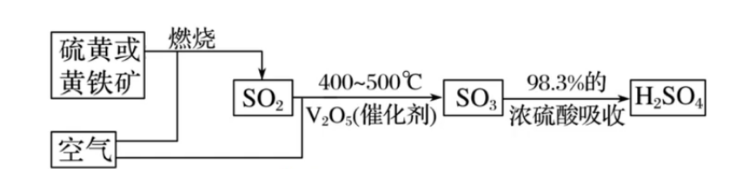
2.3 硫酸根离子的检验
-
$\ce{SO^2-_4}$的检验
实验探究:
-
稀硫酸或$\ce{Na2SO4}$溶液现象为有白色沉淀生成,加盐酸后白色沉淀不溶解。
-
$\ce{Na2CO3}$溶液现象为有白色沉淀生成,加盐酸后白色沉淀溶解且放出气体。
-
$\ce{SO^2-_4}$的检验一般思路:待测液先加稀盐酸酸化无沉淀无气体生成白色沉淀生成。
- 粗盐中可溶性杂质的除去
| 杂质 | 加入的试剂 | 化学方程式 |
|---|---|---|
| $\ce{Na2SO4}$ | $\ce{BaCl2}$溶液 | $\ce{Na2SO4 + BaCl2 -> BaSO4↓ + 2NaCl}$ |
| $\ce{MgCl2}$ | $\ce{NaOH}$溶液 | $\ce{MgCl2 + 2NaOH -> Mg(OH)2↓ + 2NaCl}$ |
| $\ce{CaCl2}$ | $\ce{Na2CO3}$溶液 | $\ce{CaCl2 + Na2CO3 -> CaCO3↓ + 2NaCl}$ |
3 $\ce{SO2}$
3.1 物理性质
无色、有刺激性气味的有毒气体,密度比空气大,易溶于水 ($1$体积的水能溶解约$40$体积的$\ce{SO2}$)。
3.2 化学性质
3.2.1 酸性氧化物的共性
- $\ce{SO2}$与水反应: $\ce{SO2 <=> H2SO3}$
- 与碱溶液反应: $\ce{SO2}$通入$\ce{NaOH}$溶液(可用于处理尾气): $$ \begin{aligned} & \ce{SO2(少量) + 2NaOH -> Na2SO3 + H2O} \\ & \ce{SO2(过量) + NaOH -> NaHSO3} \end{aligned} $$
- 与碱性氧化物反应: $\ce{SO2 + CaO -> CaSO3}$
3.2.2 弱氧化性
$\ce{SO2}$与$\ce{H2S}$反应: $\ce{SO2 + 2H2S -> 3S + 2H2O}$ (若在溶液中进行,$\ce{S}$应打$\ce{v}$符号)。
3.2.3 强还原性
$\ce{SO2}$中$\ce{S}$是 $+4$ 价,处于中间价态,所以既有氧化性又有还原性,但还原性较强。
- $\ce{SO2}$与$\ce{O2}$反应: $\ce{SO2 + O2 <->[催化剂][\bigtriangleup] 2SO3}$
- 与$\ce{Cl2、Br2、I2}$溶液反应: $\ce{SO2 + X2 + 2H2O -> H2SO4 + 2HX}$($\text{X}$表示$\ce{Cl、Br、I}$)
- $\ce{5SO2 + 2MnO4- +2H2O -> 2Mn^2+ + 5SO4^2- + 4H+}$
3.2.4 漂白性
$\ce{SO2}$与有色物质 (如品红溶液) 结合形成不稳定的无色物质,加热后可以复原。
$\ce{SO2}$能漂白品红、鲜花等有机色素,不能漂白酸碱指示剂,如酚酞、石蕊等。工业上常用$\ce{SO2}$来漂白纸浆、毛、丝、草帽等还用于消毒、杀菌等。
氯水漂白原理与$\ce{SO2}$不同,次氯酸具有强氧化性,可以将有色物质氧化为无色物质,且褪色后不能恢复为原来的颜色。
$\ce{SO2}$与氯水混合反而不会增强漂白效果,会失效: $\ce{SO2 + Cl2 + 2H2O -> H2SO4 +2HCl}$
$\ce{SO2}$能使溴水、高锰酸钾褪色 ,是因为其还原性而不是漂白性。
4 $\ce{SO3}$
4.1 物理性质
常温下,$\ce{SO3}$是一种无色液体;标准状况下,$\ce{SO3}$为固体。
4.2 化学性质
4.2.1 酸性氧化物的共性
- $\ce{SO3}$与水反应: $\ce{SO2 -> H2SO4}$
- 与碱溶液反应: $\ce{SO3}$与$\ce{Ca(OH)2}$反应: $\ce{SO3 + Ca(OH)2 -> CaSO4 + H2O}$
- 与碱性氧化物反应: $\ce{SO3 + CaO -> CaSO4}$
4.3 工业制法
工业上可将$\ce{SO3}$催化氧化制取$\ce{SO3}$: $\ce{SO2 + O2 <=>[催化剂][\bigtriangleup] 2SO3}$
5 不同价态含硫物质的转化
5.1 自然界中硫的存在和转化
5.1.1 硫的存在
-
在自然界中硫元素主要以化合态形式存在,通常以 硫化物 的形式存在,如黄铁矿($\ce{FeS2}$)、黄铜矿($\ce{CuFeS2}$)。在地表附近,硫化物转化为硫酸盐,如石膏($\ce{CaSO4·2H2O}$)、芒硝($\ce{Na2SO4·10H2O}$)等。
-
游离态的硫存在于火山口附近或地壳的岩层中。
5.1.2 硫的转化
火山口附近的硫单质会被大气中的$\ce{O2}$氧化成$\ce{SO2}$,$\ce{SO2}$可被进一步氧化成$\ce{SO3}$。
5.2 常见硫的价态及转化
-
硫元素常见的化合价有$-2, 0, +4, +6$,可以通过氧化还原反应实现不同价态含硫物质的相互转化。
利用氧化剂,可将硫元素从低价态转化到高价态;利用还原剂,可将硫元素从高价态转化到低价态。
-
硫的不同价态所对应的常见化合物
-
含有$-2$价硫的物质有酸:$\ce{H2S}$,盐:$\ce{Na2S}$、$\ce{NaHS}$等。
-
含有$+4$价硫的物质有氧化物:$\ce{SO2}$,酸: $\ce{H2SO3}$,盐:$\ce{Na2SO3}$、$\ce{NaHSO3}$等。
-
含有$+6$价硫的物质有氧化物:$\ce{SO3}$,酸:$\ce{H2SO4}$,盐:$\ce{Na2SO4}$、$\ce{NaHSO4}$等。
-
-
不同价态硫元素之间的相互转化
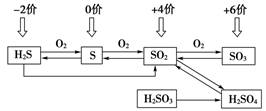
不同价态硫元素之间的相互转化主要通过氧化还原反应实现。
上述转化中,从左到右,硫元素化合价升高,需加入氧化剂;
从右到左,硫元素化合价降低,需加入还原剂。
-
相同价态硫元素之间的转化
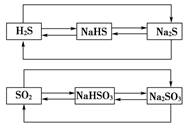
以上两种转化关系均属于相同价态硫元素之间的转化,从左到右的转化,加入碱可以实现;从右到左的转化,加入酸可以实现。