氮及其化合物
1 氮气
氮气分子内两个氮原子间以共价三键 ($\ce{N\equiv N}$) 结合,断开该化学键需要较多能量,所以氮气的化学性质较稳定。但在高温、放电条件下,氮气能够与镁、氧气、氢气等物质发生化合反应。
与 $\ce{O2}$ 反应: $\ce{N2 + O2 ->[放电 / 高温] 2NO}$; 与 $\ce{Mg}$ 反应: $\ce{Mg + N2 ->[点燃] Mg3N2}$ (镁在空气中燃烧既有氧化镁生成又有氮化镁生成)。
1.1 工业合成氨与氮肥
反应原理: $\ce{N2 + 3H2 <=>[催化剂][高温高压] 2NH3}$; 主要用途: 以合成氨为基础的化肥工业对粮食增产的贡献率占 $50%$ 左右。 化学氮肥: 主要包括铵态氮肥 (主要成分 $\ce{NH4+}$)、硝态氮肥 (主要成分 $\ce{NO3-}$) 和有机氮肥 (尿素)。工业上用氨气和二氧化碳在一定条件下合成尿素,肥效高,易保存,使用方便,是目前使用量很大的一种氮肥。
1.2 氮的固定
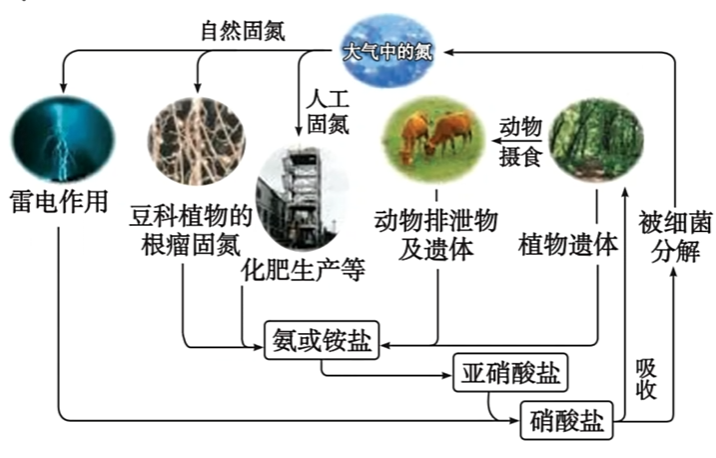
氮的固定即将大气中游离态的氮转化为氮的化合物的过程;
1.2.1 自然固氮
高能固氮: 大自然通过闪电释放的能量将空气中的氮气转化为含氮化合物(雷雨发庄稼)。
$$ \begin{aligned} & \ce{N2 + O2 \xlongequal{放电}2NO}\\ & \ce{2NO + O2 = 2NO2}\\ & \ce{3NO2 + H2O =2 HNO3 +NO} \end{aligned} $$生物固氮: 豆科植物的根瘤菌将氮气转化为氨
1.2.2 人工固氮
如工业合成氨: $\ce{N2 + 3H2 <=>[高温、高压][催化剂] 2NH3}$
1.3 氮的循环
2 $\ce{NO}$和$\ce{NO2}$
2.1 $\ce{NO}$
2.1.1 物理性质
| 颜色 | 状态 | 气味 | 毒性 | 水溶性 |
|---|---|---|---|---|
| 无色 | 常温为气态 | 无味 | 有毒 | 不溶 |
2.1.2 化学性质
$\ce{NO}$在空气中易转化为红棕色的$\ce{NO2}$,反应方程式为: $\ce{2NO + O2 -> 2NO2}$
2.1.3 实验室制法
- $\ce{Cu}$和稀$\ce{HNO3}$反应: $\ce{3Cu + 8HNO3(稀) -> 3Cu(NO3)2 + 2NO ^ + 4H2O}$;
- 收集: 只能用排水法;
- 尾气吸收: 混合$\ce{O2}$通入$\ce{NaOH}$溶液。
2.2 $\ce{NO2}$
2.2.1 物理性质
| 颜色 | 状态 | 气味 | 毒性 | 水溶性 |
|---|---|---|---|---|
| 红棕色 | 常温为气态 | 刺激性气味 | 有毒 | 易溶 |
2.2.2 化学性质
$\ce{NO2}$与$\ce{H2O}$反应生成$\ce{HNO3}$和$\ce{NO}$,反应方程式为: $\ce{3NO2 + H2O ->2HNO3+NO}$。
2.2.3 实验室制法
- $\ce{Cu}$和稀$\ce{HNO3}$反应: $\ce{Cu + 4HNO3(浓) -> Cu(NO3)2 + 2NO2 ^ + 2H2O}$
- 收集: 只能用向上排空气法
- 尾气吸收: $\ce{2NO2 + 2NaOH -> NaNO3 + NaNO2 + H2O}$
3 氨和铵盐
3.1 氨
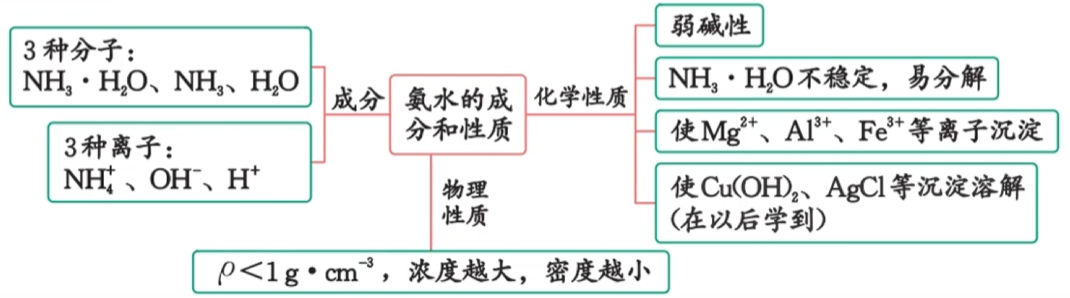
3.1.1 物理性质
| 颜色 | 状态 | 气味 | 密度 | 熔沸点 | 毒性 | 水溶性 |
|---|---|---|---|---|---|---|
| 无色 | 常温为气态 | 刺激性气味 | 小于空气 | 很容易液化 | 有毒 | 极易溶(在常温常压下,1体积水大约可溶解 700 体积氨) |
3.1.2 化学性质
-
$\ce{NH3}$与水反应的化学方程式为: $\ce{NH3 + H2O <=> NH3·H2O <=> NH4+ + OH-}$ 。
-
$\ce{NH3}$与酸反应生成铵盐
-
浓氨水挥发出的$\ce{NH3}$与浓盐酸挥发出的$\ce{HCl}$相遇形成白烟,即$\ce{NH4Cl}$晶体小颗粒; 反应的方程式为: $\ce{NH3 + HCl -> NH4Cl}$。
-
氨通入稀硫酸中反应的离子方程式为$\ce{NH3 + H+ -> NH4+}$。
注意$\ce{NH3 + HNO3 -> NH4NO3}$ 元素推断: $\ce{N}$元素的气体氢化物与最高价氧化物对应水化物反应生成盐 -
-
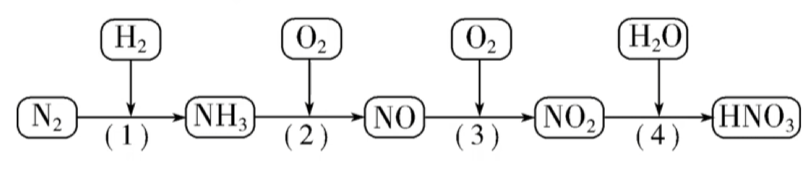
氨的催化氧化 氨中氮元素的化合价为$-3$价,氨有还原性。在加热和有催化剂(如铂或$\ce{Cr2O3}$)的条件下能被氧气氧化生成$\ce{NO}$和$\ce{H2O}$。氨的催化氧化是工业制硝酸的基础。
氨催化氧化制$\ce{HNO3}$的系列反应方程式依次为:
$$ \begin{aligned} & \ce{4NH3 + 5O2 ->[催化剂][\triangle] 4NO + 6H2O} \\ & \ce{2NO + O2 -> 2NO2} \\ & \ce{3NO2 + H2O -> 2HNO3 + NO} \end{aligned} $$
3.2 铵盐
3.2.1 物理性质
铵盐大多是无色晶体,绝大多数的铵盐都易溶于水。
易于被农作物吸收,因此广泛用于化肥中。
3.2.2 化学性质
-
不稳定性——受热易分解:
- $\ce{NH4Cl ->[\triangle] NH3 ^ + HCl}$
- $\ce{NH4HCO3 ->[\triangle] NH3 ^ + H2O + CO2 ^}$
-
与碱反应放出氨
- $\ce{NH4Cl}$与浓$\ce{NaOH}$溶液反应:$\ce{NH4Cl + NaOH ->[\triangle] NH3 ^ + NaCl + H2O}$;
- 溶液中铵盐与强碱反应的离子方程式(加热):$\ce{NH4^+ + OH- ->[\triangle] NH3 ^ + H2O}$;
- 稀溶液中铵盐与强碱反应的离子方程式(不加热):$\ce{NH4^+ + OH- -> NH3·H2O}$
3.2.3 检验
原理: $\ce{NH4^+ + OH- ->[\triangle] NH3 ^ + H2O}$
%%{init: {"flowchart": {"htmlLabels": false}} }%%
graph LR
A[铵盐] -->|"`$\ce{NO3}$`"| B[氨气]
4 硝酸
4.1 物理性质
| 颜色 | 状态 | 气味 | 特性 |
|---|---|---|---|
| 无色 | 液态 | 刺激性气味 | 易挥发 |
4.2 化学性质
-
具有酸的通性。 如$\ce{CaCO3}$与$\ce{HNO3}$反应:$\ce{CaCO3+2HNO3(稀) -> Ca(NO3)2+CO2 ^ + H2O}$
-
不稳定性:见光或者受热易分解。
$\ce{4HNO3 ->[△/光照] 4NO2 ^ + O2 ^ + 2H2O}$
浓硝酸一般呈黄色是由于硝酸分解产生的JNO,溶于硝酸的缘故。
硝酸浓度越大越易分解,因此,浓硝酸应放入棕色瓶(避免受热分解),用玻璃塞而不能用橡胶塞(硝酸腐蚀橡胶)。
-
强氧化性
-
$\ce{Cu}$与浓硝酸反应: $\ce{Cu + 4HNO3(浓) -> Cu(NO3)2 + 2NO2 ^ + 2H2O}$ $\ce{Cu}$与稀硝酸反应: $\ce{3Cu + 8HNO3(稀) -> 3Cu(NO3)2 + 2NO ^ + 4H2O}$
-
与$\ce{Fe、Al}$反应:常温下,浓硝酸或浓硫酸可使$\ce{Fe、Al}$表面形成一层致密的氧化物薄膜,所以可以用铁制容器或铝制容器来盛装浓硝酸或浓硫酸。
当加热时,$\ce{Fe、Al}$会与浓硝酸或浓硫酸发生反应。
-
浓硝酸在加热条件下,能与木炭等非金属单质发生氧化还原反应: $\ce{c + 4H2SO4(浓) ->[\triangle] CO2 ^ + 4NO2 ^ + 2H2O}$
-
硝酸的酸性 硝酸是一元强酸,具有酸的通性,能与碱性氧化物、碱、盐等反应。如$\ce{SO2 Fe^2+ FeO Fe3O4 Br- I- S^2- SO3^2-}$
技巧浓硝酸和浓盐酸的混合物(体积比为 $1 : 3$ )叫做王水,能使一些不溶于硝酸的金属(如金、铂)等溶解。 -
4.3 硝酸的工业制法
工业上制硝酸的原理是将氨经过一系列反应得到硝酸。
4.4 用途
硝酸是重要的化工原料,可用于制造化肥 、炸药、染料、农药等。
5 人类活动对环境的影响
5.1 酸雨
正常雨水由于溶解了二氧化碳,其$pH$约为$5.6$,而酸雨的$pH < 5.6$。
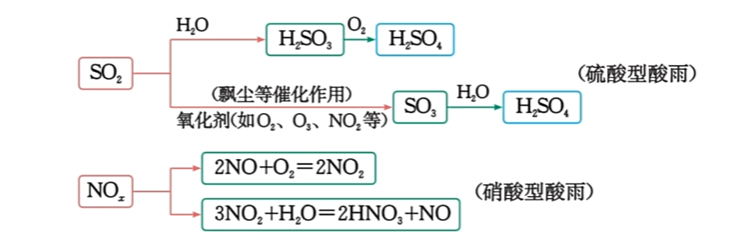
- 酸雨成因:主要是大气中的$\ce{S}$和$\ce{NO_x}$以及它们在大气中发生反应后的生成物溶于水形成的。
-
危害:
-
直接损伤农作物,破坏森林和草原,使土壤、湖泊酸化;
-
加速建筑物、桥梁、工业设备、运输工具及电缆的腐蚀。
-
- 减少硫酸型酸雨:
- 钙基固硫: $\ce{2CaO + 2SO2 + O2 ->[高温] 2CaSO4}$
- 氨水吸收
- 减少硝酸型酸雨: $\ce{2NO + 2CO ->[催化剂] N2 + 2CO2}$
5.2 光化学烟雾
以$\ce{NO}$和$\ce{NO2}$为主的氮氧化物是形成光化学烟雾、雾霾及酸雨的一个重要原因。
汽车尾气中的氮氧化物与碳氢化合物经紫外线照射发生反应形成的有毒烟雾,成为光化学烟雾。
为了预防和控制氮氧化物的污染,具体措施为安装汽车尾气净化装置净化装置含有钯(Pd)等金属元素催化剂。
尾气通过净化装置后,其中的有害气体$\ce{NO 、CO}$、CO转化为无害气体$\ce{N2}$与$\ce{CO2}$。